Белки как биополимеры. Свойства и биологические функции белков
Белки- природные полимеры, состоящие из остатков альфа-аминокислот, связанных между собой пептидными связями. Белки входят в состав клеток и тканей всех живых организмов. Они участвуют в важнейших процессах живого организма- обмене веществ, размножении, росте организма, работе мышц и т.д. Являются основной составной частью нашей пищи.
История изучения Белки были выделены в отдельный класс биологических молекул в XVIII веке в результате работ французского химика Антуана Фуркруа. Голландский химик Геррит Мульдер провёл анализ состава белков и выдвинул гипотезу, что практически все белки имеют сходную эмпирическую формулу. Термин «протеин» для обозначения подобных молекул был предложен в 1838 году шведским химиком Якобом Берцелиусом. Мульдер также определил продукты разрушения белков аминокислоты и для одной из них (лейцина) с малой долей погрешности определил молекулярную массу 131 дальтон. В 1836 Мульдер предложил первую модель химического строения белков. Основываясь на теории радикалов, он сформулировал понятие о минимальной структурной единице состава белка, C16H24N4O5, которая была названа «протеин», а теория «теорией протеина» Голландский химик Геррит Мульдер провёл анализ состава белков и выдвинул гипотезу, что практически все белки имеют сходную эмпирическую формулу. Термин «протеин» для обозначения подобных молекул был предложен в 1838 году шведским химиком Якобом Берцелиусом. Мульдер также определил продукты разрушения белков аминокислоты и для одной из них (лейцина) с малой долей погрешности определил молекулярную массу 131 дальтон. В 1836 Мульдер предложил первую модель химического строения белков. Основываясь на теории радикалов, он сформулировал понятие о минимальной структурной единице состава белка, C16H24N4O5, которая была названа «протеин», а теория «теорией протеина»

Строение белков Немецкий химик Эмиль Фишер, предположил, что белки представляют собой полимеры аминокислот, соединенных пептидной связью. Идея о полимерном характере строения белков как известно высказывалась еще Данилевским и Хертом, но они считали, что "мономеры" представляют собой очень сложные образования - пептоны или «углеазотные комплексы». Доказывая пептидный тип соединения аминокислотных остатков. Э. Фишер исходил из следующих наблюдений. Во-первых, и при гидролизе белков, и при их ферментативном разложении образовывались различные аминокислоты. Другие соединения было чрезвычайно трудно описать а еще труднее получить. Кроме того Фишеру было известно, что у белков не наблюдается преобладания ни кислотных, ни основных свойств, значит, рассуждал он, амино- и карбоксильные группы в составе аминокислот в белковых молекулах замыкаются и как бы маскируют друг друга. Успешная реализация работы привела Фишера к успеху. Работая над ней он параллельно уже в гг. впервые доказал, что в состав белков входят только L-стереоизомеры аминокислот. пептидная связь
![]()

Структуры белка Первичная структураПервичная структура последовательность аминокислот в полипептидной цепи. Важными особенностями первичной структуры являются консервативные мотивы сочетания аминокислот, играющих ключевую роль в функциях белка. Консервативные мотивы сохраняются в процессе эволюции видов, по ним часто удаётся предсказать функцию неизвестного белка. консервативные мотивыэволюции Первичная структураконсервативные мотивыэволюции

Вторичная структура локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями. водородными связямиводородными связями Типы вторичной структуры белков: - α-спирали;α-спирали - β-листы (складчатые слои) ;β-листыскладчатые слои - π-спирали; - 3-спирали; -неупорядоченные фрагменты. Вторичная структура белка

Третичная структура пространственное строение полипептидной цепи (набор пространственных координат составляющих белок атомов). Структурно состоит из элементов вторичной структуры, стабилизированных различными типами взаимодействий, в которых гидрофобные взаимодействия играют важнейшую роль. В стабилизации третичной структуры принимают участие: ковалентные связи (между двумя остатками цистеина дисульфидные мостики); ковалентные связи (между двумя остатками цистеина дисульфидные мостики); ионные связи между противоположно заряженными боковыми группами аминокислотных остатков; ионные связи между противоположно заряженными боковыми группами аминокислотных остатков; водородные связи; водородные связи; гидрофильно-гидрофобные взаимодействия. гидрофильно-гидрофобные взаимодействия.

Четвертичная структура (или субъединичная, доменная) взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса. Белковые молекулы, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности и лишь после окончания синтеза образуют общую надмолекулярную структуру. В состав белка с четвертичной структурой могут входить как идентичные, так и различающиеся полипептидные цепочки. В стабилизации четвертичной структуры принимают участие те же типы взаимодействий, что и в стабилизации третичной. Надмолекулярные белковые комплексы могут состоять из десятков молекул.


Фибриллярные белки белки, имеющие вытянутую нитевидную структуру, в которой отношение поперечной оси к продольной больше 1:10. Большинство фибриллярных белков не растворяется в воде, имеет большую молекулярную массу и высоко регулярную пространственную структуру, которая стабилизируется, главным образом, взаимодействиями (в том числе и ковалентными) между различными полипептидными цепями. Первичная и вторичная структура фибриллярного белка также, как правило, регулярна. белки, имеющие вытянутую нитевидную структуру, в которой отношение поперечной оси к продольной больше 1:10. Большинство фибриллярных белков не растворяется в воде, имеет большую молекулярную массу и высоко регулярную пространственную структуру, которая стабилизируется, главным образом, взаимодействиями (в том числе и ковалентными) между различными полипептидными цепями. Первичная и вторичная структура фибриллярного белка также, как правило, регулярна.

Глобулярные белки белки, в молекулах которых полипептидные цепи плотно свёрнуты в компактные шарообразные структуры глобулы (третичные структуры белка). белки, в молекулах которых полипептидные цепи плотно свёрнуты в компактные шарообразные структуры глобулы (третичные структуры белка). К глобулярным белкам относятся ферменты, иммуноглобулины, некоторые гормоны белковой природы (например, инсулин) а также другие белки, выполняющие транспортные, регуляторные и вспомогательные функции.

Химические Свойства Денатурация-частичное или полное разрушения пространственной структуры, присущей данной белковой молекуле. Может иметь обратимый или необратимый характер. Денатурация просходит под действием: Денатурация-частичное или полное разрушения пространственной структуры, присущей данной белковой молекуле. Может иметь обратимый или необратимый характер. Денатурация просходит под действием: - высокой температуры - высокой температуры - растворов кислот, щелочей и концентрированных растворов солей - растворов кислот, щелочей и концентрированных растворов солей - растворов солей тяжёлых металлов - растворов солей тяжёлых металлов - некоторых органических веществ (формальдегида, фенола) - некоторых органических веществ (формальдегида, фенола) - радиоактивного излучения - радиоактивного излучения

Цветные реакции Биуретовая реакция- при нагревании мочевины образуется биурет, который с раствором сульфата меди в присутствии щелочи даёт фиолетовое окрашивание. Биуретовую реакцию дают вещества, содержащие амидную группу, а в молекуле белка эта группа присутствует.



Функции белков Структурная функция; Структурная функция; Защитная функция; Защитная функция; Регуляторная функция; Регуляторная функция; Сигнальная функция; Сигнальная функция; Транспортная функция; Транспортная функция; Запасная (резервная) функция; Запасная (резервная) функция; Рецепторная функция; Рецепторная функция; Моторная (двигательная) функция. Моторная (двигательная) функция.


«Жизнь - есть способ существования белковых тел»
Ф. Энгельс.
Введение
Белки вместе с нуклеиновыми кислотами, липидами, углеводами, некоторыми
низкомолекулярными органическими веществами, минеральными солями и водой
образуют протоплазму всех земных организмов - животных и растительных, сложных
и элементарных. Термин «протоплазма» предложен чешским физиологом Пуркине
(1839) для обозначения содержимого живой клетки. Содержание белков в
протоплазме, как правило, значительно выше, чем всех остальных ее компонентов
(не считая воду). В большинстве случаев на белки приходится до 75-80 % сухой
массы клеток.
Белковые вещества представляют главную, наиболее активную часть протоплазмы: «В
протоплазме ярче просвечивают свойства той составной части, которая
присутствует в большем количестве и которая наиболее активна «Данилевский А. Я.
(основное вещество протоплазмы и его видоизменение жизнью. 1894).
Убеждение в перворазрядном значении белков для жизни остается непоколебленным и
в наше время несмотря на открытие роли нуклеиновых кислот в явлениях
наследственности, выяснение важнейшего значения для жизнедеятельности
витаминов, гормонов и т. д.
Благодаря особенностям своего состава и структуры белки обнаруживают
замечательное разнообразие физических и химических свойств. Известны белки,
совершенно нерастворимые в воде, есть белки, крайне неустойчивые, изменяющиеся
под влиянием видимого света или даже легкого механического прикосновения. Есть
белки, молекулы которых имеют вид нитей, достигающих в длину нескольких
миллиметров, и есть белки, молекулы которых представляют шарики диаметром в
несколько десятков ангрем. Но во всех случаях строение и свойства белков находятся
в тесной и ответливой связи с выполняемой ими функцией.
I. Строение белков.
Белки представляют собой самый многочисленный и наиболее разнообразный класс
органических соединений клетки. Белки - это
биологические гетерополимеры
,
мономерами которых являются аминокислоты. все аминокислоты имеют как минимум по
одной аминогруппе (-NH 2) и карбоксильную группу (-COOH) и
различаются структурной и физико-химическими свойствами радикалов (R).
Пептиды, содержащие от нескольких аминокислотных остатков до нескольких
десятков, существуют в организме в свободной форме и обладают высокой
биологической активностью. К ним относят ряд гормонов (окситоцин,
адренокортикотропный гормон), некоторые очень токсичные ядовитые вещества
(например, аманитин грибов), а также многие антибиотики, производимые
микроорганизмами.
Белки представляют собой высокомолекулярные полипептиды, в состав которых
входят от ста до нескольких тысяч аминокислот.
II. Классификация белков
Белки подразделяются на протеины (простые белки), состоящие только из остатков
аминокислот, и протеиды (сложные белки), которые при гидролизе дают
аминокислоты и вещества небелковой природы (фосфорную кислоту, углеводы,
гетероциклические соединения, нуклеиновые кислоты). Протеины и протеиды
разделяются на ряд подгрупп.
Протеины
Альбумины - белки, имеющие сравнительно небольшую молекулярную массу, хорошо
растворяются в воде. Из водных растворов высаливаются насыщенным раствором
сульфата аммония, при нагревании свертываются (денатурируют). Белок яйца
-
типичный представитель альбуминов. Многие из них получены в кристаллическом
состоянии.
Глобулины - белки, нерастворимые в чистой воде, но растворимые в теплом 10
%-ном растворе Nacl. Чистый глобулин извлекают, разбавляя солевой раствор
большим количеством воды. Глобулин - самые распространенные белки, входят в
состав мышечных волокон, крови, молока, яйца, растительных семян.
Проламины незначительно растворимы в воде. Растворяются в 60-80 %-ном водном
этиловом спирте. При гидролизе проламинов образуется в большом количестве
аминокислота - пролин. Характерны для семян злаков. Примером их может служить
глиадин - главный белок клейковины
пшеницы.
Глютелины растворимы только в 0,2 %-ной щелочи. Найдены в семенах пшеницы,
риса, кукурузы.
Протамины - обнаружены только в молоках рыб. На 80 % состоят из щелочных
аминокислот, поэтому являются сильными основаниями. Совершенно не содержат
серы.
Склеропротеины - нерастворимые белки, имеют нитевидную (фибриллярную) форму
молекул. Содержат серу. К ним относятся коллаген (белки хрящей, некоторых
костей), эластин (белки сухожилий, соединительных тканей), кератин (белки
волос, рогов, копыт, верхнего слоя кожи), фиброин (белок нитей сырого шелка).
Протеиды. Сложные белки делятся на группы в зависимости от состава их
небелковой части, которая называется простетической группой. Белковая часть
сложных белков называется апобелком.
Липопротеиды - гидролизуются на простой белок и липиды
. Липопротеиды содержатся
в большом количестве в составе зерен хлорофилла и протоплазмы клеток, биологических
мембран.
Гликопротеиды - гидролизуются на простые белки и высокомолекулярные углеводы.
Не растворяются в воде, но растворяются в разбавленных щелочах. Содержатся в
различных слизистых выделениях животных, в яичном белке,
Хромопротеиды - гидролизуются на простые белки и красящие вещества. Например,
гемоглобин крови распадается на белок глобин и сложное азотистое основание,
содержащее железо.
Нуклеопротеиды - гидролизуются на простые белки, обычно протамины, или гистоны,
и нуклеиновые кислоты.
Фосфопротеины - содержат фосфорную кислоту. Играют большую роль в питании
молодого организма. Примером их является казеин - белок молока
.
III. Структурная организация белковых молекул
Поскольку белки состоят из нескольких десятков аминокислот, соединенных в
полипептидную цепь, клетке энергетически невыгодно держать их в виде цепочки
(так называемая развернутая форма). Поэтому белки подвергаются компактизации,
укладке, в результате которой они приобретают определенную пространственную
организацию - пространственную структуру.
Выделяют 4 уровня пространственной организации белков.
Первичная структура - последовательность аминокислот в составе полипептидной
цепи и определяется последовательностью нуклеотидов в участке молекулы ДНК,
кодирующем данный белок. Первичная структура любого белка уникальна и
определяет его форму, свойства и функции.
Вторичная структура большинства белков имеет вид спирали и возникает в
результате образования водородных связей между - СО - и NH - группами разных
аминокислотных остатков полипептидной цепи.
Третичная структура имеет вид клубка или глобулы, и образуется в результате
сложной пространственной укладки молекулы белка. Для каждого вида белка
характерна специфическая формула глобулы. Прочность третичной структуры
обеспечивается разнообразными связями, возникающими между радикалами
аминокислот (дисульфидными, ионными, гидрофобными).
Четвертичная структура представляет собой сложный комплекс, объединяющий
несколько третичных структур (например, белок гемоглобин образован четырьмя
глобулами), удерживающихся нековалентными связями: ионными, водородными и
гидрофобными.
Изменение пространственной формы, а следовательно, свойств и биологической
активности нативного белка называют денатурацией. Денатурация может быть
обратимой и необратимой. В первом случае нарушается четвертичная, третичная или
вторичная структура и возможен обратный процесс восстановления структуры белка
- ренатурация, во втором - происходит разрыв пептидных связей в составе
первичной структуры. Денатурация вызывается химическими воздействиями, высокой
температурой (выше 45 град. С), облучением, высоким давлением и т. д.
V. Выделение белков
Белки экстрагируют из природного материала водой, растворами солей, щелочей,
кислот, водно-спиртовыми растворами. Полученный таким образом продукт обычно
содержит значительное количество примесей. Для дальнейшего выделения и очистки
белка раствор обрабатывают солями (высаливание), насыщают спиртом или ацетоном,
нейтрализуют. При этом выделяется соответствующая фракция белка. Выделить белок
в неизменном состоянии очень трудно, для этого необходимо соблюдать целый ряд
условий: низкие температуры, определенную реакцию среды и т. д.
Выделенные и очищенные белки в большинстве случаев представляют собой белый
порошок или сохраняют природную форму (например, белки шерсти и шелка).
По форме молекул белки можно разделить на две группы: фибриллярные, или
нитевидные, и глобулярные, или шаровидные. Фибриллярные белки, как правило,
выполняют структурообразующие функции. Их свойства (прочность, растяжимость)
зависят от способа упаковки полипептидных цепочек, поэтому после выделения
белки обычно сохраняют природную форму. Примером фибриллярных белков могут
служить фиброин шелка, кератины, коллагены.
Ко второй группе относится большинство белков, содержащихся в организме
человека. Для глобулярных белков характерно наличие участков с высокой
реакционной способностью (они могут быть каталитическими центрами ферментов)
или образовывать комплексы с другими молекулами за счет приближенных друг к другу
в пространстве функциональных групп.
VI. Цветные реакции белков
Для белков характерны некоторые цветные реакции, связанные с наличием в их
молекуле определенных группировок и аминокислотных остатков.
Биуретовая реакция - появление фиолетового окрашивания при обработке белка
концентрированным раствором щелочи и насыщенным раствором CuSO 4 .
Связана с наличием в молекуле пептидных связей.
Ксантопротеиновая реакция - появление желтой окраски в результате действия на
белки концентрированной азотной кислоты. Реакция связана с наличием в белке
ароматических колец.
Миллионова реакция - появление вишнево-красного окрашивания при действии на
белок Миллонова реактива (раствор нитрата ртути в азотистой кислоте). Реакция
объясняется присутствием в белке фенольных группировок.
Сульфгидрильная реакция - выпадение черного осадка сернистого свинца при
нагревании белка с раствором плюсбита (связана с наличием в белке
сульфгидрильных групп).
Реакция Адамкевича - появление фиолетового окрашивания при добавлении к белку
глиоксалевой и концентрированной серной кислот. Связана с наличием индольных
группировок.
VII. Расшифровка первичной структуры белка
Расшифрововать первичную структуру белка - это значит установить его формулу,
т. е. определить, в какой последовательности аминокислотные остатки расположены
в полипептидной цепи.
Знание первичной структуры белка хорошо иллюстрируют данные работы Ингрэма,
исследовавшего причины одного распространенного в некоторых районах Африки и
Средиземноморья наследственного заболевания крови, так называемой серповидной
анемии. Больные серповидной анемией бледны, жалуются на слабость, одышку при
малейшем напряжении. Они редко доживают до 12-17 лет. При анализе крови у ни
обнаруживается необычная форма эритроцитов. Эритроцит у больных имеют вид
серпов или полулуний, тогда как нормальные эритроциты имеют форму
двояковогнутых дисков. При детальном исследовании выяснилось, что гемоглобин в
здоровых эритроцитах распределен по всей клетке равномерно и беспорядочно, в
эритроцитах же больных анемией гемоглобин образует правильные кристаллические
структуры. Благодаря кристаллизации гемоглобина происходит деформация
эритроцитов. В чем же причина столь существенного изменения гемоглобина? Ингрэм
изолировал гемоглобин из крови больных серповидной анемией и произвел анализ
его первичной структуры. При этом выяснилось, что отличие гемоглобина больных
от гемоглобина здоровых состоит только в том, что в полипетпидный цепи
гемоглобина больных на 6-м месте (от N-конца) находится остаток валина (вал), в
то время, как на том же месте в гемоглобине здоровых находится глуталиновая
кислота (глу). Молекула гемоглобина состоит из четырех субъединиц (четырех
полипептидных цепей_ - двух альфа и двух бетта с общим числом аминокислотных
остатков, равным: 141х2 + 146х2 + 574. Замена «глу» на «вал» имеет место в
альфа-цепях, т. е. в двух цепях из четырех. Таким образом, в молекуле,
состоящей из 574 аминокислотных остатков, достаточно заменить только два, а
остальные 572 оставить без изменения, чтобы произошли глубокие изменения
свойств гемоглобина. Если изменить его способность кристаллизоваться и
связывать кислород, то произойдут роковые последствия для здоровья людей.
Сэнгер (Кембридж, Англия) еще в 40-х годах приступил к расшифровке первичной
структуры белка инсулина. В ходе кропотливых и трудоемких исследований Сэнгер
разработал ряд новых методов и приемов анализа. Эти работы проводились им в
течение более 10 лет и увенчались полным успехом: формула инсулина была
установлена, и за его выдающиеся достижения автор удостоен Нобелевской премии
(1958). Значение работ Сэнгер состоит не только в расшифровке первичной
структуры инсулина, но и в этом, что был приобретен опыт, разработаны новые
методы, доказана реальность этих исследований. После работ Сенджера это было
легче делать другим исследователям. Действительно, вслед за Сенджером во многих
лабораториях были развернуты работы по расшифровке первичной структуры ряда
белков, усовершенствованы методы анализа и разработаны новые методы.
VIII. Функции белков
Каталитическая
Белки - ферменты вырабатываются живыми организмами; они обладают каталитическим
действием, т. е. способностью увеличивать скорости определенных химических
реакций. На ферментативном действии основаны процессы брожения, с
доисторических времен применяемые при производстве вин, уксуса, пива и хлеба. В
1680 г. голландский натуралист Антони Левенгук использовал микроскоп
собственной конструкции для наблюдения клеток дрожжей и бактерий; однако он не
считал их живыми организмами. В 1857 г. Луи Пастер показал, что дрожжи
представляют собой живой организм, а брожение - физиологический процесс. В 1897
г. Э. Бюхнеру удалось доказать, что брожение может происходить без участия
целых дрожжевых клеток. Проэкстрагировав дрожжевые клетки, он получил раствор,
не содержащий клеток, но обладающий ферментативной активностью (содержащий
фермент, или энзим). Слово «энзим» происходит от греческого en 2yme - в
закваске.
Вплоть до 1926 г. не было получено никаких данных, свидетельствующих о том, что
ферменты - это белки. Только в 1926 г. Джеймсу Б. Самнеру (1887-1955),
работавшему в Корнеллском университете, удалось выделить из соевых бобов в
чистом виде и получить в кристаллической форме фермент уреазу Уреаза - белок,
катализирующий гидролитическое расщепление мочевины
СО(NH 2) 2 + H 2 O - CO 2 + 2NH 3
Молекулярная масса уреазы 480000; молекула состоит из шести субъединиц.
Известно около 2000 различных ферментов, часть их подробно изучена. По
современной классификации все ферменты делятся на шесть классов.
1. Оксиредуктазы или окислительно-восстановительные ферменты. Это большая
группа, состоящая из 180-190 ферментов. Оксиредуктазы ускоряют окисление или
восстановление различных химических веществ. Так, относящийся к этому классу
фермент алкогольдегидрогеназа катализирует окисление этилового спирта в
уксусный альдегид и играет большую роль в процессе спиртового брожения.
Фермент липоксигеназа окисляет кислородом воздуха ненасыщеннные жирные кислоты.
Действие этого фермента является одной из причин прогоркания муки и крупы.
2. Трансферазы. Представители этой группы ферментов катализируют перенос различных групп с одной молекулы на другую, например, фермент тирозинаминотрансфераза катализирует перенос аминогруппы. Ферменты этой группы играют большую роль в медицине.
3. Гидролазы. Ферменты этой группы катализируют реакции гидролиза.
Представители этой группы ферментов имеют большое значение в процессах
пищеварения, в пищевой и других отраслях промышленности. Так, фермент липаза
катализирует гидролиз глицеридов с образованием свободных жирных кислот и
глицерина. Гидролиз пектиновых веществ протекает с участием пектолитических
ферментов, их применение дает возможность повысить выход и осветлить
плодово-ягодные соки.
Представителем группы гидролаз являются амилазы, катализирующие гидролиз
крахмала. Они нашли широкое применение в спиртовой, хлебопекарной,
крахмало-паточной промышленностях.
К гидролазам относится большая группа протеолитических ферментов,
катализирующих гидролиз белков и пептидов. Они применяются в легкой и пищевой промышленности.
С их помощью провозят «мягчение» мяса, кожи, получение сыров.
4. Лиазы. Катализируют реакции расщепления между атомами углерода, угдерода и кислорода, углерода и азота, углерода и галогена. К ферментам этой группы относятся декарбоксилазы, отщепляющие молекулу диоксида углерода от органических кислот.
5. Изомеразы. Ферменты этой группы катализируют разнообразные перегруппировки внутри молекулы органического соединения.
6. Лигазы. катализируют образование связей С - О; С - S; С - N; С - С.
Характерной особенностью ферментов является их высокая эффективность (они
способны катализировать сложнейшие реакции в очень мягких условиях) и строгая
направленность. Действие ферментов чрезвычайно сильно зависит от ряда факторов:
температуры (оптимальная температура 30-50 град. С), кислотности среды,
присутствия специфических веществ, носящих название активаторов и ингибиторов.
Первые повышают активность ферментов, вторые снижают (угнетают ферменты).
Сейчас налажено промышленное производство ряда ферментных препаратов.
Применение их в различных отраслях промышленности дает большой экономический
эффект.
Строительная функция - являются структурными компонентами биологических мембран
и многих внутриклеточных органелл, главным компонентом опорных структур организма
(коллаген хрящей и сухожилий; эластин соединительной ткани; кератин волос и
ногтей).
Транспортная функция. Ряд белков крови способны присоединять и переносить
различные вещества. Альбумин транспортирует жирные кислоты, альфа- и бета-
глобулина переносит кислород. Транспортную функцию осуществляют белки -
переносчики плазматических мембран.
Регуляторная функция. Многие гормоны являются веществами белковой природы,
например: инсулин, глюкагон (антагонист инсулина), аденокортикотропный гормон
(АКТГ) и некоторые другие.
Защитная функция. Ее выполняют иммуноглобулины крови, являющиеся антителами,
фибрин и тромбин, участвующие в свертывании крови и останавливающие
кровотечение. Сюда же можно отнести группу антиоксидантных ферментов
(супероксиддисмутазу - СОД, каталазу), которые препятствуют развитию
свободно-радикальных процессов, чрезвычайно вредных для организма.
Сократительная функция. Благодаря движению относительно друг друга нитей белков
актина и миозина осуществляется сокращение мышц.
Рецепторная функция. Некоторые белки, встроенные в клеточную мембрану, образуют
рецепторы, которые «воспринимают информацию» от молекул гормонов.
Пищевые белки - питают зародыш на ранних стадиях развития и запасают
биологически ценные вещества и ионы (казеин молока; ферритин, запасающий железо
в селезенке).
IX. Как синтезируют белок
Как ни странно, интезировать белок искусственно иногда бывает проще, чем
установить его структуру. пусть структура белка известна. Как же получить его в
колбе?
Зададимся целью синтезировать искусственно один из самых простых белков -
инсулин. Как мы уже говорили, молекула инсулина состоит из двух частей А и В.
Очевидно, нужно получить отдельно обе цепи, а затем соединить их. Итак, синтез
цепи В молекулы инсулина. Будем проводить его с С - конца цепи. Первая
аминокислота - аланин. В первую очередь возьмем основу, к которой будем
постепенно, кислоту за кислотой, приращивать инсулиновую цепь. В качестве такой
основы можно брать ионообменные смолы, полистирол. Прикрепим к основе через карбоксильную
группу первую аминокислоту - аланин.
Итак, аланин карбоксильной группой зацепился з смолу, но аминогруппа у него
свободна. Теперь к этой аминогруппе надо прикрепить через карбоксильную группу
следующую аминокислоту - аланин.
Итак, аланин карбоксильно группой зацепился за смолу, но аминогруппа у него
свободна. теперь к этой аминогруппе надо прикрепить через карбоксильную группу
следующую аминокислоту - лизин. Как это сделать? Хороший способ получения
амидной связи между карбоксилом и аминогруппой - ацилирование последней
хлорангидридом кислоты. При этом выделяется хлористый водород. Так и поступим.
Возьмем хлорангидрид лизина и подействуем им на... Стоп! Ничего хорошего не
получится. Дело в том, что в самом лизине есть аминогруппа, и не понятно,
почему хлорангидрид лизина должен взаимодействовать лишь с аминогруппой первой
аминокислоты (аланина), а не даст полиамид лизина.
Как же быть? Чтобы выйти из положения, нужно защитить аминогруппу лизина от
действия хлорангидридов. Для этого ее ацилируют ангидридом трифторуксусной
кислоты. Почему именно трифторуксусной, а не просто уксусной, почему
аминогруппу нельзя просто проацетилировать, т. е. защитить группой COCH 3 ?
Оказывается, ацетильная группа «держится» за аминогруппу прочно, а наша цель -
посадить ее «на время». Трифторацетил же потом легко будет «снять», не разрушая
образовавшегося пептида.
Значит, следующая стадия заключается в ацилирование по аминогруппе
«привязанного» к смоле аланина хлорангидридом трифторацетилированного (тоже по
аминогруппе) лизина. В случае лизина дело осложняется, но ее можно защитить
какой-то группой Х, которая не отцепляется с нее во время синтеза и удаляется
только в самом конце.
В результате мы получаем дипептид с защищенной аминогруппой. Теперь аминогруппу
надо освободить. Защиту снимаем, действуя слабым раствором щелочи, и получаем
свободную аминогруппу, способную принять следующую аминокислоту - пролин.
Очередная стадия теперь уже понятна - действуем на пептид хлоронгидридом
трифторацетилированного треонина и т. д., пока не построим всю цепь из 30-ти
аминокислот. Присоединяем последнюю кислоту - фенилаланин, снимаем защитную
группу и, действуя кислотой, отсоединяем готовую цепь от смолы.
Таким же образом синтезируем вторую цепь, соединяем обе цепи, и искусственный
инсулин готов! Не так просто и не так быстро, не правда ли? Да, работа требует
терпения и времени.
Тем не менее, в 1968 г. Мэрифилду удалось синтезировать сравнительно сложный
белок - фермент рибонуклеазу. Он состоит из 124 аминокислот. Этот синтез включал
11931 стадию (подобных тем, что мы только что разобрали), он был проведен всего
за три недели.
Х. Заключение
Синтез белка в лаборатории - венец достижений биорганической химии ХХ в. -
потребовал громадных затрат времени и средств. А в живой клетке синтез белка
идет с ошеломляющей легкостью: сборка молекулы гемоглобина, состоящей из 574
аминокислотных остатков, заканчивается в 90 сек. Разработка и внедрение в
производство биологических способов получения белоксодержащихся продуктов и
белков - также часть программы «химической бионики». В Киришах (Ленинградская
область) в конце 1974 г. вступил в строй и выдал первую продукцию завод
«Биохим», на котором выращивают кормовые дрожжи на такой казалось бы,
малопривлекательной среде, как нефтепродукты. В более отдаленной перспективе
намечается разработка синтеза белка на основе достижений «генной инженерии».
Белки будут производиться на генетических заводах, в одних цехах которых будут
конструироваться гены, в других синтезироваться нужные белки.
Примеры, показывающие громадное и все увеличивающееся расширение сферы
приложения молекулярной биологии, можно продолжить, но и так ясно, что
революция в биологии превратила ее в мощную и многообещающую производительную
силу, способную ставить и разрешать задачи, еще недавно показавшиеся совершенно
фантастическими. В этом отношении весьма интересна, например, точка зрения
академика В. А. Энгельгардта по поводу возможности в наше время создать
искусственно живое образование, т. е. синтезировать жизнь: «Не давая себя увлекать
слишком поспешными декларациями...можно все же с полной определенностью
утверждать, что цель, так недавно казавшаяся недосягаемой, - искусственное
создание простейших форм живого - вполне достижима».
Литература:
1. Грин Н, Стаут, У. Тейлор Д. Биология в 3-х т. Т. 1: Пер. с англ. /Под ред.
Р. Сопера. М.: Мир, 1990. 368 с., ил.
2. Браун А. Д. и Фадеева М. Д. Молекулярные основы жизни. Пособие для учителей.
М., Просвещение, 1976.
3. Шульпин Г. Б. Эта увлекательная химия. М.: Химия, 1984.
4. Л. Полинг, П. Полинг. Химия. Изд. Мир. Москва. 1978.
5. Нечаев А. П. Органическая химия: учеб. для учащихся пищевых техникумов. М.:
высш. иск., 1988. 319 с., ил.
6. Палов И. Ю., Вахненко Д. В., Москвичев Д. В. Биология. Пособие - репетитор
для поступающих в вузы. Ростов-на-Дону. Изд. Феникс. 1999. 576 с.
7. Биология для поступающих в вузы. Под ред. В. Н. Ярыгина. М.: высш. шк.,
1995. 487 с., ил.
Реферат плюс
Презентация по химии
на тему:
«Белки –
природные
полимеры»

БЕЛКИ - это азотсодержащие высокомолекулярные органические вещества со сложным составом и строением молекул.
Белок можно рассматривать как сложный полимер аминокислот.
Белки входят в состав всех живых организмов, но особо важную роль они играют в животных организмах, которые состоят из тех или иных форм белков (мышцы, покровные ткани, внутренние органы, хрящи, кровь).

Характерной особенностью белков является их многообразие, связанное с
количеством, свойствами и способах соединения входящих в их молекулу
аминокислот.
В состав белков входит 20 различных аминокислот, отсюда следует огромное многообразие белков при различных комбинациях аминокислот. Как из 33 букв алфавита мы можем составить бесконечное число слов, так из 20 аминокислот – бесконечное множество белков. В организме человека насчитывается до 100 000 белков.

Растения синтезируют белки из углекислого газа СО2 и воды Н2О за счет фотосинтеза, усваивая остальные элементы белков (азот N, фосфор Р, серу S, железо Fe, магний Mg) из растворимых солей, находящихся в почве.
Животные организмы в основном получают готовые аминокислоты с пищей и на их
базе строят белки своей организма. Ряд аминокислот (заменимые аминокислоты)
могут синтезироваться непосредственно животными организмами.

Строение белков
Белки представляют собой нерегулярные полимеры, построенные из остатков аминокислот.
Остатки аминокислот в белках соединены амидной связью между амино- и карбоксильными группами. Связь между двумя аминокислотными остатками обычно называется пептидной связью, а полимеры, построенные из остатков аминокислот, соединенных пептидными связями, называют полипептидами.
Таким образом, белок представляет собой полипептид, содержащий сотни или
тысячи аминокислотных звеньев.
Белок как биологически значимая структура может представлять собой как один полипептид, так и несколько полипептидов, образующих в результате
нековалентных взаимодействий единый комплекс.

Немного из истории..
Историческая справка.
Первая гипотеза о строении молекулы белка была предложена в 70-х годах XIX в. Это была уреидная теория строения белка. В 1903 г. немецкий ученый Э.Г.Фишер предложил пептидную теорию, которая стала ключом к тайне строения белка. Фишер предположил, что белки представляют собой полимеры из остатков аминокислот, соединенных пептидной связью NH–CO.
Идея о том, что белки – это полимерные образования, высказывалась еще в 1888 г. русским ученым А.Я.Данилевским. Согласно полипептидной теории белки имеют определенную структуру. В клетке находятся свободные аминокислоты, составляющие аминокислотный фонд, за счет которого происходит синтез новых белков. Этот фонд пополняется аминокислотами, постоянно поступающими в клетку вследствие расщепления белков пищи пищеварительными ферментами или собственных запасных белков.
Э.Г.Фишер
А. Я. Данилевский

Классификация
Белки подразделяют на протеины (простые белки) и протеиды (сложные белки)

Функции белков
Функции белков.
Защищают организм от микробов и вирусов, участвуя в выработке антител;
Регулируют энергобаланс, особенно при больших нагрузках или при дефиците в пище жиров и углеводов.
Обеспечивают рост, размножение и полноценное развитие организма, особенно нервной системы, регулируя раздражимость и реакции на внешние раздражители;
Входят в состав гормонов, мышц и других тканей;
В связи с витаминами и микроэлементами являются биологическими катализаторами - ферментами;
Формируют способность высшей формы движения материи - мышление;

Элементный состав
белков
Элементный состав белков
23% кислорода, 6-7% водорода, 0,3-2,5% серы.
В составе отдельных белков обнаружены также фосфор, йод, железо, медь и некоторые другие макро- и микроэлементы, в различных, часто очень малых количествах.
за исключением азота, концентрация которого характеризуется наибольшим
постоянством.

Структура белков
Особый характер белка каждого вида связан не только с длиной, составом и строением входящих в его молекулу полипептидных цепей, но и с тем, как эти цепи ориентируются.
В структуре любого белка существует несколько степеней организации:
Первичная структура белков
1 . Первичная структура белка - специфическая последовательность аминокислот в полипептидной цепи.
Даже одинаковые по длине и аминокислотному составу пептиды могут быть разными веществами потому, что последовательность аминокислот в цепи у них разная.

Вторичная структура белков
Вторичная структура белка - способ скручивания полипептидной цепи в
пространстве (за счет водородной связи между водородом амидной группы -NH- и
карбонильной группы - СО-, которые разделены четырьмя аминокислотными
фрагментами).
В одном и том же белке могут присутствовать все три способа укладки полипептидной цепи:
Вторичная структура – спираль с одинаковым расстоянием между витками.
Третичная структура белков
Третичная структура белка - реальная трехмерная конфигурация закрученной спирали полипептидной цепи в пространстве (спираль, скрученная в спираль).
Третичная структура белка обуславливает специфическую биологическую активность белковой молекулы. Третичная структура белка поддерживается за счет взаимодействия различных функциональных групп полипептидной цепи:
· дисульфидный мостик (-S-S-) между атомами серы,
· сложноэфирный мостик – между карбоксильной группой (-СО-) и
гидроксильной (-ОН),
· солевой мостик - между карбоксильной (-СО-) и аминогруппами (NH2).

Четвертичная структура белка
Четвертичная структура белка - тип взаимодействия между несколькими
полипептидными цепями.
Например, гемоглобин представляет из себя комплекс из четырех макромолекул
Физические свойства
Белки имеют большую молекулярную массу (104-107),
многие белки растворимы в воде, но образуют, как правило, коллоидные растворы, из которых выпадают при увеличении концентрации неорганических солей, добавлении солей тяжелых металлов, органических растворителей или при нагревании
Белки способны к набуханию, характеризуются оптической активностью и подвижностью в электрическом поле, некоторые растворимы в воде. Белки имеют изоэлектрическую точку.

Химические свойства
Важнейшим свойством белков является их способность проявлять как
кислотные, так и основные свойства, то есть выступать в роли амфотерных
электролитов.

Свойство а мфотерности лежит в основе буферных свойств белков и их
участии в регуляции рН крови.

Химические свойства
2. Качественные реакции на белок:
биуретовая реакция: фиолетовое окрашивание при обработке солями меди в щелочной среде (дают все белки),
ксантопротеиновая реакция: желтое окрашивание при действии
концентрированной азотной кислоты, переходящее в оранжевое под действием
выпадение черного осадка (содержащего серу) при добавлении ацетата свинца
(II), гидроксида натрия и нагревании.
- Денатурация - разрушение вторичной и третичной структуры белка.
Необратимая денатурация
белка куриного яйца под воздействием высокой температуры

3. Гидролиз белков - при нагревании в щелочном или кислом растворе с
образованием аминокислот.
Реакцию гидролиза с образованием аминокислот в общем виде можно записать так:

Горение
Белки горят с образованием азота, углекислого газа и воды, а также некоторых других веществ. Горение сопровождается характерным запахом жженых перьев.
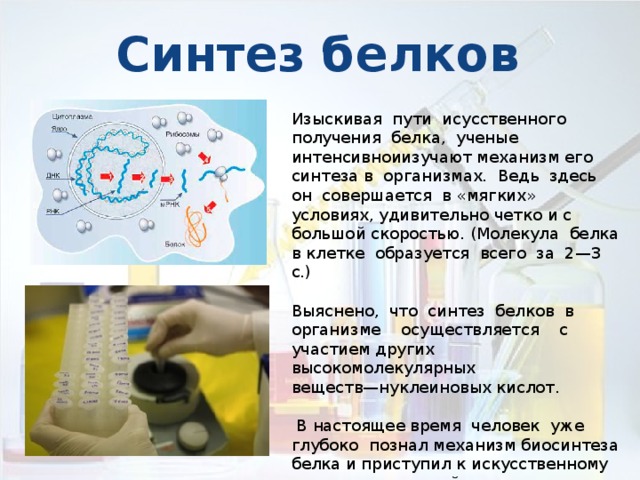
Синтез белков
Изыскивая пути исусственного получения белка, ученые интенсивноиизучают механизм его синтеза в организмах. Ведь здесь он совершается в «мягких» условиях, удивительно четко и с большой скоростью. (Молекула белка в клетке образуется всего за 2-3 с.)
Выяснено, что синтез белков в организме осуществляется с участием других высокомолекулярных
веществ-нуклеиновых кислот.
В настоящее время человек уже глубоко познал механизм биосинтеза белка и приступил к искусственному получению важнейших
белков на основе тех же принципов, которые столь совершенно отработаны в
процессе развития органического мира.

Вывод
В данной работе были рассмотрены химические и физические свойства белков, классификация белков, состав и строение белков, были рассмотрены разнообразные функции белков, а также их значение.
Доказано, что белки - обязательная составная часть всех живых клеток, играют исключительно важную роль в живой природе, являются главным, наиболее ценным и незаменимым компонентом питания. Это связанно с той огромной ролью, которую они играют в процессах развития и жизни человека. Белки являются основой структурных элементов и тканей, поддерживают обмен веществ и энергии, участвуют в процессах роста и размножения, обеспечивают механизмы движений, развитие иммунных реакций, необходимы для функционирования всех органов и систем организма.
"Жизнь - это форма существования белка"

Полнотекстовый поиск:
Главная > Реферат >Химия
Литература:
Гауровиц Ф. «Химия и функции белков», издательство «Мир», Москва 1965 г.
Малая мед. Энциклопедия, Том 1, стр.899-910.
3.С.А.Пузаков. «Химия», М. «Медицина», 1995г.
Роль белков.
Аминокислотный состав белков.
Размеры и форма молекул белков.
Химический состав и свойства.
Строение.
Катаболизм белков.
Обнаружение и определение.
Классификация.
Обмен и биосинтез.
Лечебное применение.
Белки в питании.
Белки играют особую роль, так как они представляют со-бой один из незаменимых компонентов живого
Белки играют особую роль, так как они представляют собой один из незаменимых компонентов живого. Во всех явлениях роста и воспроизведения решающую роль играют белки и нуклеиновые кислоты.
Как это следует из самого названия белков, или протеинов, в течении долгого времени в них видели основной компонент живой материи.
Основной химического строения белков весьма прост: они состоят из длинных цепей остатков аминокислот, соединенных между собой пептидными связями. Усложнение структуры белков возникает в следствие наличия в пептидных цепях около 20 различных видов аминокислотных остатков, вследствие большой длины этих цепей, содержащих до нескольких сот аминокислотных остатков, а также из-за особых конформаций пептидных цепей, т.е. их специфического сворачивания, приводящего к возникновению определённой трёхмерной структуры. Если бы даже белки представляли собой прямые пептидные цепи, лишённые изгибов, то и тогда они обладали бы практически бесконечным разнообразием - только за счёт различной последовательности 20 аминокислот в длинных цепях. Но ведь любая из таких цепей может принимать бесконечное число конформаций, поэтому не удивительно, что каждый вид растений или животных обладает своими собственными белками, специфичными для данного вида.
В настоящее время известно огромное число белков с самыми разнообразными свойствами. Неоднократно делались попытки создать классификацию белков. В основе одной из классификаций лежит растворимость белков в различных растворителях. Белки, растворимые при 50% насыщения сульфата аммония, были названы альбуминами; белки же, которые в этом растворе выпадают в осадок были названы глобулинами. Последний класс был подразделён на эуглобулины, нерастворимые в воде, свободной от солей, и на псевдоглобулины, которые растворимы в этих условиях. Однако растворимость белков в солевых растворах зависит не только от концентрации солей, но и от рН, температуры и других факторов.
Аминокислотный состав белков.
Белки подвергаются гидролизу, действуя на них кислотами, основаниями и ферментами. Чаще всего их кипятят с соляной кислотой. При постоянной температуре кипит только 20,5%-ная НСI; поэтому концентрированную соляную кислоту разводят. Для полного гидролиза нужно кипятить белок с соляной кислотой в течение 12-70 часов.
Полный гидролиз белков осуществляют также, нагревая их с гидроксидом бария или с гидроксидами щелочных металлов. Преимущество гидролиза с Ва(ОН)2 заключается в том, что его избыток можно осадить эквивалентным количеством серной кислоты. Щелочные гидролизаты бесцветны и не содержат гумина. Однако щелочной гидролиз страдает рядом недостатков: происходит рацемизация аминокислот, дезаминирование некоторых из них, а так же разложение аргинина на орнитин и мочевину и разрушение цистина и цистеина.
Наконец, полный гидролиз белков проводят при помощи протеолитических ферментов в очень мягких условиях. В ферментативных гидролизатах содержится не только трептофан, но также глутамин и аспарагин. Ферментативный гидролиз особенно ценен в тех случаях, когда требуется получить промежуточные пептиды в результате частичного гидролиза.
Термин «первичная структура» обычно употребляется для обозначения химической формулы белков, т.е. последовательности, в которой аминокислоты соединены пептидными связями. Это понятие не учитывает ни электростатического взаимодействия между положительно и отрицательно заряженными группами белков, ни вандерваальсовых сил. Дисульфидные связи цистина, способные образовывать «мостики» между различными участками одной пептидной цепи или разных пиптидных цепей, менее стабильны, чем углерод-углеродные связи или даже пептидные связи. Дисульфидные мостики могут размыкаться и вновь замыкаются на других участках пептидной цепи, вовлекая другие сульфгидрильные группы. Таким образом, их роль в структуре белков можно назвать промежуточной между ролью более прочных ковалентных связей и вышеупомянутых боле слабых связей. Дисульфидные мостики затрудняют анализ последовательности аминокислот в белках.
Первый этап в изучении первичной структуры белков и пептидов заключается в определении N-концевой аминокислоты, т.е. аминокислоты со свободной -аминогруппой. Эту аминокислоту можно при помощи какого-либо подходящего метода отщепить, выделить и идентифицировать. Повторяя процесс несколько раз, можно осуществить ступенчатый гидролиз пептидной цепи с N-конца и установить в нём аминокислотную последовательность.
Размеры и формы молекул белков.
Молекулярный вес небольших молекул можно определить по понижению точки замерзания или по повышению точки кипения их растворов, а так же по понижению давления пара растворителя.
Первые определения молекулярного веса белков были основаны на химическом определении тех элементов или аминокислот, которые содержатся в белке в очень небольших количествах.
Молекулярная масса белков колеблется от нескольких тысяч до нескольких миллионов (большинство белков имеет молекулярную массу в пределах десятков - сотен тысяч). Белки большей частью растворимы в воде или солевых растворов, образуя растворы, обладающие свойствами коллоидов. В живых тканях белки в той или иной степени гидратированы. В растворах белки весьма неустойчивы и легко выпадают в осадок при нагревании или других воздействиях, нередко теряя при этом нативные свойства, в т.ч. растворимость в исходном растворителе (свёртывание, денатурация).
Являясь полимерами аминокислот, белки содержат свободные кислотные (карбоксильные) и основные (гидратированные аминные) группы, благодаря чему молекулы белков несут как отрицательные, так и положительные заряды. В растворах белки ведут себя как биполярные (амфатерные) ионы. В зависимости от преобладания кислотных или основных свойств белки реагируют как слабые кислоты или как слабые основания. При понижении рН (подкислении) раствора кислотная диссоциация подавляется, а щелочная - усиливается, вследствие чего общий заряд белковой частицы становится положительным и в электрическом поле она стремится к катоду. При повышении рН (подщелачивании) происходит подавление щелочной диссоциации и усиление кислотной, благодаря чему частица белка заряжается отрицательно. При определённом рН, называемом изоэлектрической точкой, кислотная диссоциация равна щелочной и частица в целом становится неподвижной в электрическом поле.
Значение изоэлектрической точки характерно для каждого данного белка и зависит главным образом от соотношения кислотных и основных групп, а также от их диссоциации, обусловливаемой строением белковой молекулы. У большинства белков изоэлектрическая точка лежит в слабокислой среде, однако имеются белки и с резким преобладанием щелочных свойств. В изоэлектрической точке вследствие потери заряда и уменьшения гидратации белковые частицы наименее устойчивы в растворе и легче свёртываются при нагревании, а также осаждаются спиртом или другими агентами.
Под действием кислот, щелочей или протеолитических ферментов белки подвергаются гидролизу, т.е. распадаются с присоединением элементов воды. Продуктами полного гидролиза белков являются аминокислоты. В качестве промежуточных продуктов гидролиза образуются пептиды и полипептиды. Начальные высокомолекулярные продукты гидролиза белков - альбумозы (протеозы) и пептоны - химически не охарактеризованы и, по-видимому, представляют собой высокомолекулярные полипептиды.
В молекуле белка остатки аминокислот соединены между собой при помощи пептидных связей -СО-NН-. Соответственно этому такие соединения называют пептидами или полипептидами (если аминокислотных остатков много). Полипептидные цепочки являются основой строения белковой молекулы. Поскольку полипептиды могут быть построены из различных аминокислот, повторяющихся разное число раз и расположенных в различной последовательности, и, учитывая, что в состав белков входит более 20 аминокислот, возможное число различных индивидуальных белков практически бесконечно.
Реакционная способность белков также очень разнообразна, т.к. в их состав входят радикалы различных аминокислот, несущие весьма активные химические группы. Присутствие ряда атомных группировок, расположенных в той или иной последовательности на определённой структуре белковой молекулы, обуславливает уникальные и чрезвычайно специфичные свойства индивидуальных белков, играющие важную биологическую роль.
Молекула белка построена из одной или нескольких полипептидных цепочек, иногда замкнутых в кольцо при помощи пептидных, дисульфидных или других связей и соединённых между собой.
Пептидные цепочки обычно закручены в спирали и часто соединены в более крупные агрегаты. Так, молекула панкреатической рибонуклеазы состоит из одной полипептидной цепочки, содержащей 124 аминокислотных остатка.
Последовательность аминокислот в полипептидной цепочке определяет первичную структуру белка. Пространственно полипептидные цепочки расположены в виде определённых спиралей, конфигурация которых поддерживается при помощи водородных связей. Из таких спиралей наиболее распространена -спираль, в которой 3,7аминокислотных остатка приходится на один виток. Это пространственное расположение цепочки называют вторичной структурой белка. Отдельные участки полипептидных цепей могут быть соединены между собой дисульфидными или другими связями, как это имеет место в молекуле рибонуклеазы между 4 парами остатков цистеина, благодаря чему вся цепочка может быть свёрнута в клубок или иметь определённую сложную конфигурацию. Это складывание или закручивание спирали, имеющей вторичную структуру, называют третичной структурой. Наконец, образование агрегатов между частицами, имеющими третичную структуру, рассматривают как четвертичную структуру белка.
Первичная структура является основой белковой молекулы и часто определяет биологические свойства белка, а также вторичную и третичную его структуры. С другой стороны, растворимость белка и многие физико-химические и биологические свойства зависят от вторичной и третичной структур. Наличие структур высшего порядка не обязательно: они могут обратимо появляться и исчезать. Так, многие белки волокнистого характера, например кератины волос, коллагены соединительной ткани, фиброин шелка и др., имеют волокнистое строение и называются фибриллярными белками. У глобулярных белков частица свёрнута в клубок. В ряде случаев переход из глобулярного в фибриллярное состояние обратим. Например, белок мышечных волокон актомиозин при изменении концентрации солей в растворе легко переходит из фибриллярной в глобулярную форму и обратно.
Денатурация белка сопровождается потерей белком нативных свойств (биологической активности, растворимости). Денатурация происходит при нагревании растворов белков или воздействии на них ряда агентов. Денатурация белка заключается в потере ими вторичной и третичной структуры белка.
КАТАБОЛИЗМ БЕЛКОВ.
Белки, как и другие органические вещества, из которых состоит организм, постоянно обновляются. В среднем период полупревращения белков организма человека составляет около 80 суток, причём эта величина значительно варьирует в зависимости от типа белка и его функции. Различают долгоживущие белки, гидролиз которых проходит только в лизосомах в присутствии специальных ферментов; короткоживущие белки, разрушение которых происходит в отсутствие лизосомных ферментов; аномальные белки период плупревращения которых не превышает 10-12 мин.
В норме в организме взрослого человека за сутки обновляется до 2% от общей массы белков, т.е. 30-40г. Распаду подвергаются в основном мышечные белки. Большая часть аминокислот, образующихся при гидролизе белков (около 80%), вновь используется для биосинтеза белков, значительно меньшая часть расходуется в синтезе специализированных продуктов: например, некоторых медиаторов, гормонов и др. Не включающиеся в анаболические процессы аминокислоты разрушаются, как правило, до конечных продуктов окисления. В составе мочевины организм человека теряет ежедневно 5-7 г. азота, входящего в состав ранее синтезированных белков. Аминокислоты, поступающие с белком пищи, в отличии от моносахаридов и жирных кислот в организме не депонируются. Для постоянно идущего процесса синтеза белков нужно необходимое поступление аминокислот в организм. Это обуславливает особую ценность белков как пищевых продуктов. При белковом дефиците развивается кахексия. Детская дистрофия, характерная для ряда районов Западной Африки и обусловленная резким сокращением поступления белков после перевода с грудного питания на преимущественно углеводную диету, получила название «квашиоркор». Избыточное количество аминокислот используется в качестве энергодативных веществ.
Ферменты, ускоряющие гидролиз белков и полипептидов в тканях, называются тканевыми протеиназами (катепсинами); они обладают специфичностью действия: катепсин А, например, является ферментом с эктопептидазной, а катепсин В- с эндопептидазной активностью. Наибольшая активность протеиназ наблюдается в печени, селезёнке, почках.
Регулируемая активность тканевых протеиназ обеспечивает обновляемость белков на необходимом организму уровне, гидролиз диффектных и чужеродных белков, а также частичный протеолиз, необходимый для активации некоторых ферментов (песина и трепсина) и гормонов (инсулина).
ОБНАРУЖЕНИЕ И ОПРЕДИЛЕНИЕ.
Присутствие белков в биологических или других жидкостях может быть установлено рядом качественных реакций. Из реакций осаждения наиболее характерны свёртывание при кипячении, осаждение спиртом или ацетоном, кислотами, особенно азотной кислотой. Весьма характерно осаждение белков трихлоруксусной или сульфосалициловой кислотами. Последние два реактива особенно употребительны как для обнаружения белков, так и для количественного осаждения их из биологических жидкостей. Из цветных реакций на белки наиболее характерна биуретовая реакция: фиолетовое окрашивание с солями меди в щелочном растворе (пептидные связи белков дают комплексное соединение с медью). Другая характерная реакция на белки - ксантопротеиновая: желтое окрашивание в осадке белка от добавления концентрированной азотной кислоты. Реакция Миллона (с солями ртути в азотной кислоте, содержащей азотистую) протекает с фенольным остатком тирозина, и поэтому красное окрашивание дают только белки, содержащие тирозин. Остаток триптофана в белке даёт реакцию Адамкевича: фиолетовое окрашивание с концентрированной уксусной кислотой в концентрированной серной кислоте; реакция обязана глиоксиловой кислоте, находящейся в уксусной в качестве примеси, и получается также с дркгими альдегидами. Белки дают ряд других реакций, зависящих от находящихся в них радикалов аминокислот.
КЛАССИФИКАЦИЯ.
Классификация белков в значительной мере условна и построена на различных, часто случайных, признаках. Белки разделяют на животные, растительные и бактериальные, на фибриллярные и глобулярные, мышечные, нервной ткани и т.п. Учитывая исключительное многообразие белков, ни одну классификацию нельзя считать удовлетворительной, поскольку многие индивидуальные белки не подходят ни к одной группе. Обычно принято делить белки на простые (протеины), состоящие только из остатков аминокислот, и сложные (протеиды), содержащие также простетические (небелковые) группы.
Простые белки делятся на: альбумины, глобулины, проламины, глютелины, склеропротеины, протамины, гистоны.
Сложные белки делятся на: нуклеопротеиды, мукопротеиды, фосфопротеиды, металлопротеиды, липопротеиды.
ОБМЕН И БИОСИНТЕЗ.
Белки играют важнейшую роль в питании человека и животных, являясь источником азота и незаменимых аминокислот. В пищеварительном тракте белки перевариваются до аминокислот, в виде которых всасываются в кровь и подвергаются дальнейшим превращениям. Ферменты, действующие на белки сами являются белками. Каждый из них специфически расщепляет определённые пептидные свёзи в белковой молекуле. К протеолитическим ферментам пищеварительного тракта относятся: пепсин желудочного сока, трипсин поджелудочного сока и ряд пептидаз поджелудочного и кишечного соков.
Биосинтез белков в организме - важнейший процесс, лежащий в основе нормального и патологического роста и развития, а также регуляции обмена веществ путём образования определённых ферментов. Через биосинтез белков осуществляется и передача биологической информации, в частности наследственных признаков.
ЛЕЧЕБНОЕ ПРИМЕНЕНИЕ.
Ряд белков и белковых продуктов находит лечебное применение. Прежде всего это касается лечебного (диетического) питания. Гидролизаты белков и смеси аминокислот используются для парэнтерального питания. Белки сыворотки крови применяются для общего укрепления организма и повышения его защитных свойств. Наконец, многие гормоны (инсулин, адренокортикотропный и другие гормоны гипофиза) и ферменты (пепсин, трипсин, химотрепсин, плазмин) находят широкое лечебное применение.
БЕЛКИ И ПИТАНИЕ.
Белки в питании человека нельзя заменить другими пищевыми веществами. Недостаток белка в пище приводит к нарушению здоровья, вызываемому расстройством синтеза ряда жизненно важных белков, ферментов и гормонов.
При безбелковом питании человек весом 65 кг выделяет 3,1-3,6 г азота в сутки, что соответствует распаду 23-25 г тканевых белков. Эта величина отражает внутренние траты белков взрослым человеком. Однако потребность человека в пищевом белке значительно выше указанной величины. Это связано с тем, что аминокислоты белков пищи потребляются не только для синтеза белка, но значительная их часть используется в качестве энергетического материала.
В таблице показаны примерные наборы пищевых продуктов, содержащие суточную норму белка.
|
Продукты |
Кол-во продукта в г |
Кол-во белка в г |
Продукты |
Кол-во продукта в г |
Кол-во белка в г |
Продукты |
Кол-во продукта в г |
Кол-во белка в г |
|
Картофель |
Картофель |
|||||||
|
Картофель |
||||||||
|
Белки являются аминокислотными полимерами . В настоящее время описано... из них являются составными частями белка . В белке пшеницы обнаружено всего 20 аминокислот... Полимеры , их получение, свойства и применениеКонтрольная работа >> БиологияМиллионов. По происхождению полимеры делят на: Природные, биополимеры (полисахариды, белки , нуклеиновые кислоты... и применению – белки , полисахариды, нуклеиновые кислоты, пластмассы, эластомеры, волокна. Природные полимеры . Свойства, применение... Полимеры (6)Реферат >> Физика...), полиамиды, мочевиноформальдегидные смолы, белки , некоторые кремнийорганические полимеры . Полимеры , макромолекулы которых наряду с углеводородными... спирали, характерная для белков и нуклеиновых кислот, возникает и у виниловых полимеров и полиолефинов, ... Белки и нуклеиновые кислотыУчебное пособие >> Химия... Белками (протеинами, от греческого protas – первый, важнейший) называют высокомолекулярные природные полимеры ... , молекулы которых построены из остатков аминокислот. Поразительно то, что все белки ... Нуклеиновые кислоты это полимеры , состоящие из... | ||||||||
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
АЛТАЙСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Химический факультет
Курсовая работа
Тема: Строение полимеров, биополимеров
Строение белков
Работу выполнила:
студентка 4 курса
Проверил:
к. х.н., доцент
«___»_____________2002г.
Оценка_______________
_______________________
(подпись руководителя)
Барнаул·2002
1. Что такое полимер?. 4
1.1. Особенности строения полимеров. 4
2. Природные полимеры.. 6
2.1. Волокна. 6
2.2. Каучук. 7
2.3. Биологические полимеры.. 7
3. Синтетические полимеры.. 8
3.1. Волокна. 8
3.2. Каучуки. 9
3.3. Кристаллические полимеры.. 10
3.4. Стекла и смолы.. 10
4. Средние молекулярные массы.. 11
5. Конфигурация, стереохимия и конформация цепи. 12
6. Классификация полимеров. 15
7. Тепловые переходы в полимерах. 18
8. Белки. 20
9. Химические связи в белковой молекуле. 21
10. Уровни структурной организации молекулы белка. 23
10.1. Первичная структура. 23
10.2. Вторичная структура. 25
10.2.1. a-спиральная. 25
10.2.3. Коллагеновая спираль. 27
10.2.4. Надвторичные структуры и структурные домены.. 27
10.3. Третичная структура. 27
10.4. Четвертичная структура. 29
Литература. 31
1. Что такое полимер?
1.1. Особенности строения полимеров
Слово "полимер" дословно означает - много сегментов (от греческого polus ‑много и teros ‑части, сегменты).
Этот термин охватывает все вещества, молекулы которых построены из множества элементов, или звеньев. Эти элементы включают в себя как отдельные атомы так и (что чаще) небольшие группы атомов, соединенных химическими связями. Примера полимера с элементами, состоящими из элементарных атомов, служит так называемая "пластическая сера". Она получается при выливании расплава серы (при соответствующей температуре) в холодную воду. Структура полимерной серы можно представить в виде цепи атомов, связанных друг с другом химическими связями
В этом состоянии физические свойства серы иные, чем у обычной кристаллической или каменной серы, - они более типичны для каучукоподобных полимеров. Мягкая, очень эластичная и полупрозрачная, она не имеет в отличие от кристаллических веществ определенной точки плавления. При повышении температуры сера сначала размягчается, а затем течет как высоковязкая жидкость. Однако полимерная сера не стабильна и при комнатной температуре через несколько дней снова переходит в обычную порошкообразную или кристаллическую форму.
Для большинства полимеров повторяющимся элементом структуры являются небольшие группы атомов, соединенных определенным образом. Один из наиболее простых с точки зрения химического строения полимеров - полиэтилен имеет в качестве повторяющегося элемента группу CH2.
Исходная молекула, из которой образуется полимер, носит название мономерного звена (от греческого monos - единичный). Как показывает этот пример, мономерное звено не всегда является повторяющимся элементом цепи.
Однако не всегда звенья цепи идентичны. Многие полимеры образуются при взаимодействии двух различных видов мономерных звеньев или химических соединений. Это приводит к структуре типа
http://pandia.ru/text/78/042/images/image002_56.gif" width="333" height="19 src=">
Такое построение характерно для многих синтетических каучуков.
Одно из звеньев, скажем В, может соединится с А не только по концам, но и в третьей точке. Это дает возможность цепям разветвляться:

Такой полимер может "расти" из каждой точки разветвления, образуя сложную высоко разветвленную трехмерную структуру.
До сих пор мы не уделяли внимания вопросу о числе элементарных звеньев в молекуле, необходимом для того, чтобы вещество можно было классифицировать как полимер. Что это за число, которое составляет понятие много?
Точного ответа на этот вопрос нет. Вообще говоря, любое число от двух и более соответствует полимеру. Однако полимеры, содержащие несколько звеньев, обычно называются димерами, тримерами, тетрамерами и т. д., по числу входящих в них исходных молекул, или мономерных звеньев, а термин полимер (точнее, высокополимер ) относится к случаю, когда число входящих в цепь звеньев достаточно велико. Минимальное число мономерных звеньев высокополимера около 100. Максимальное число звеньев теоретически не ограничено
2. Природные полимеры
2.1. Волокна
Среди природных полимеров, имеющих промышленное значение, наиболее важное место занимают волокна как растительного, так и животного происхождения.
Главное свойство волокна - его высокая прочность на разрыв. Это специфическое свойство обусловлено определенным расположением молекул в структуре волокна. Волокна обычно содержат очень маленькие кристаллы и кристаллиты и эти кристаллиты вытянуты, или "ориентированы" вдоль волокна таким образом, что длинноцепочечные молекулы располагаются параллельно или почти параллельно оси волокна. Такое геометрическое расположение цепей наиболее эффективно противодействует деформации или разрушению структуры под влиянием растягивающих усилий.
Получить полный текстИздавна широко использовались природные волокна, в основе которых лежит химическое вещество - целлюлоза. Она имеет довольно сложное строение цепи, повторяющимся звеном которой является соединение C6H10O5.
Из других промышленно важных природных волокон следует упомянуть шерсть и шелк. Это продукты животного происхождения. Железы шелкопряда выделяют волокна шелка, из которых формируется кокон. С химической точки зрения шерсть и шелк - это белки, весьма обширный класс веществ, широко распространенный в мире растений и животных.
Белки отличаются от уже рассмотренных полимеров тем, что их цепь построены из повторяющихся элементов неодинакового химического строения. Общая формула элементарного звена белковой цепи
Колл" href="/text/category/koll/" rel="bookmark">коллагена , основного белка кожи.
Прочность кожи, которой добиваются химической обработкой (дубление) шкур, обусловлена сеткой составляющих их коллагеновых волокон.
3. Синтетические полимеры
3.1. Волокна
Среди волокон мы должны различать синтетические, т. е. такие, большие молекулы которых построены или синтезированы из очень простых химических соединений, и такие, которые получены из природных полимеров (обычно целлюлозы) посредствам химической переработки их в другие формы. Оба эти типа полимеров объединяются общим названием химические волокна . Для производства непрерывного нитевидного волокна исходный полимер должен быть жидким - в виде расплава или раствора. Целлюлоза как возможный материал для подобных целей имеет большой недостаток - она не только не плавится, но и не растворяется ни в воде, ни в обычных органических растворителях. Поэтому, чтобы использовать целлюлозу, ее следует подвергать обработке. Один из способов обработки состоит в том, что на целлюлозу действуют уксусной кислотой, в результате чего она превращается в ацетат целлюлозы. Ацетат целлюлозы хорошо растворяется в органических растворителях, например в ацетоне ; при этом образуется очень вязкий сиропообразный раствор, который можно продавить через многоканальную фильеру, содержащую необходимое число мельчащих отверстий; в результате получают пучок тонких волоконец, которые после вытяжки и испарения растворителя образуют непрерывную нить ацетата целлюлозы. В процессе другого типа выдавливаемая жидкая масса химически модифицированной целлюлозы подвергается обработке, превращающей ее в исходную целлюлозу. Этот продукт, известный под названием вискозный шелк, является примером регенерированного целлюлозного волокна.
Все волокна из синтетических полимеров производят в форме непрерывных нитей. В отличие от целлюлозных, эти полимеры могут быть легко расплавлены.
Синтетические волокна не следует рассматривать как заменители природных или же как "искусственные" волокна; у них иные свойства и в некоторых отношениях они превосходят природные волокна. Существуют много типов синтетических волокон: нейлоны, полиэфиры (терилен, лавсан) акриловые волокна (орлон) и полипропиленовое волокно (алстрон).
3.2. Каучуки
Наиболее важным из синтетических каучуков до второй мировой войны был буна‑каучук: повторяющимся звеном в цепи является бутадиен
Поиски различных каучуконосов велись в Африке, и хотя ряд нужных растений был найден, их потенциальный вклад оказался незначительным. Положение облегчилось с появлением американского синтетического каучука, известного как GR-S.
Он имеет более сложное строение, чем немецкий буна‑каучук, является сополимером, состоящим из двух компонентов - бутадиена и стирола. Этот каучук оказался по ряду свойств хуже натурального, его недостаточная "липкость", или адгезия, создавали трудности, например, при производстве автомобильных шин, однако эта проблема была решена после разработки технологий смешения его с небольшими количествами натурального каучука.
Получить полный текстДругим важным синтетическим каучуком является бутил‑каучук‑полимер, получаемый из изобутилена. Однако из особенностей бутил‑каучука в том, что воздух диффундирует через него значительное медленнее, чем сквозь натуральный каучук, поэтому бутил‑каучук ценен, как основа при производстве автомобильных камер. Однако по сравнению с натуральным каучуком эластические свойства его значительно хуже.
В противоположность волокнам каучуки, как правило, не кристалличны; их молекулы расположены неупорядоченно. Структура каучуков, во многом подобная структуре жидкости, называется аморфной. Именно этой рыхлой структуре (в отличие от плотно упакованной регулярной структуры кристалла) каучуки обязаны своей мягкостью и гибкостью.
3.3. Кристаллические полимеры
Третий и во многих отношениях наиболее интересный класс синтетических полимеров - это кристаллических полимеров. В отличие от обычных кристаллических твердых тел полимеры не полностью кристалличны, а содержат множество очень мелких кристаллов, существующих наряду с остальным разупорядоченным или аморфным веществом. В неориентированном состоянии они не имеют аналогов в природе, и их свойства отличаются от свойств веществ, которые были известны до сих пор.
Одним из наиболее широко и многосторонне используемых кристаллических полимеров являются полиэтилен. Он обладает превосходными изоляционными свойствами, а также легкостью и эластичностью. Полиэтилен имеет один недостаток -OH плавится при сравнительно низкой температуре (110°С-130°С)
Еще один важный кристаллический полимер - это нейлон, который имеет отличные волокнообразующие свойства, однако он может быть также получен в виде блоков для производства изделий методом литья под давлением. Tпл. (нейлона) – 265°С.
Полимерное, гетероцепное строение имеет бороводород
/text/categ/nauka.php" class="myButtonNauka">Получить полный текст

Элементорганические полимеры содержат как органические, так и неорганические группы. Примером гетероцепного элементорганического полимера является полидиметилсилоксан [-Si(CH3)2O-]n. Или, например, полиорганофосфазены[-PR2=N-]n.
Полимеры, макромолекулы которых состоят из повторяющихся звеньев одного типа, называются гомополимерами . В сополимерах макромолекулы содержат мономерные звенья нескольких типов. Ниже приведена классификация сополимеров, содержащих повторяющиеся звенья двух типов, условно обозначенные как А и В:
С точки зрения строения основной цепи макромолекулы подразделяются на линейные, двухтяжевые (две параллельные цепи, скрепленные различным образом), разветвленные и сшитые (сетчатые). Ниже приведена классификация макромолекул по строению основной цепи:
Тип конфигурации | Строение цепи |
Линейные макромолекулы | |
Двухтяжевые макромолекулы лестничные спирополимеры | |
Разветвленные макромолекулы | |
статистические | |
гребнеобразные | |
звездообразные | |
Сшитые (сетчатые) | |
в плоскости (паркетные) | |
в пространстве |
7. Тепловые переходы в полимерах
Для полимеров существует два основных типа температур перехода: температура плавления (Tпл.) и температура стеклования (Tст.).
Температура плавления - это температура плавления кристаллической фазы полимера.
Температурой стеклования называется температура, при которой аморфные области полимера приобретают свойства, характерные для стеклообразного состояния: хрупкость, жесткость и прочность. Различия между двумя указанными тепловыми переходами можно легко понять, рассматривая изменения, происходящие в различном, жидком полимере при его охлаждении. С уменьшением температуры уменьшается поступательная, вращательная и колебательная энергия в молекуле полимера. Когда суммарная энергия молекулы уменьшится до величины, при которой поступательная и вращательная энергия уже практически отсутствуют, становится возможной кристаллизация полимера. При этом если удовлетворяются определенные требования симметрии, то молекулы могут принимать упорядоченное расположение и таким образом реализуется кристаллизация. Температура, при которой происходит этот процесс, и есть Tпл.. Однако не у всех полимеров создается необходимые условия для кристаллизации. Если требования симметрии не удовлетворяются, то кристаллизация не протекает, но по мере дальнейшего снижения температуры энергия молекулы продолжает уменьшаться. При достижении Tст. сегментальное движение полимерных цепей прекращается из‑за сильного ослабления вращения связей.
Возможность реализации одного или обоих тепловых переходов зависит от его морфологии . Полностью аморфные полимеры характеризуются только Tст., тогда как полимеры полностью кристаллические полимеры имеют только Tпл.. Большинство же полимеров при Tпл. подвергаются кристаллизации лишь частично, подобные полукристаллические полимеры характеризуются температурой плавления и температурой стеклования. Тепловые переходы легко измерить по изменению таких свойств, как удельный объем, теплоемкость. На рисунке приведена зависимость удельного объема от температуры для полностью аморфного и полностью кристаллического полимера (сплошные линии). Температура плавления - этот переход первого рода с очень резким изменением удельного объема; температура стеклообразования - это переход второго рода характеризующийся лишь изменением температурного коэффициентом удельного объема. Соответствующая кривая для полукристаллического полимера состоит из кривой для кристаллического полимера и пунктирной линии, соответствующей переходной области в стеклообразное состояние.

Рис. 2. Определение температуры стеклования и температуры плавления полимера по изменению его удельного объема.
Температуры плавления и стеклования полимера влияют на механические свойства полимера при той или иной температуре и определяют температурный интервал его использования. На тот и другой термический переход, как правило, одинаково влияют молекулярная симметрия, структурная жесткость и межмолекулярное взаимодействие. Сильное межмолекулярное взаимодействие (из‑за высокой полярности или водородных связей) приводит к сильным кристаллизационным силам, что обуславливает высокие Tпл.. Сильное межмолекулярное взаимодействие понижает также подвижность цепей аморфного полимера, в результате и Tст. имеют высокие значения.
На величину Tст . и Tпл . также сильно влияет молекулярная симметрия полимерных цепей. Полимеры, структурно асимметричные (например, поливинилхлорид и полипропилен), имеют более высокие Tст . и Tпл., чем их симметричные аналоги (поливинилиденхлорид и полиизобутилен). Асимметричные цепи являются более полярными, и поэтому могут упаковываться плотнее, обеспечивая более сильное межмолекулярное взаимодействие.
8. Белки
Белки - это полимеры, точнее, сополимеры, состоящие из остатков аминокислот, различающихся природой радикала R.
Получить полный текстИх называют биополимерами:

В состав белков входят 20 наиболее универсальных, так называемых «магических» аминокислот и до десятка более редких. В макромолекулах различных белков эти аминокислоты чередуются по-разному. Химическое строение некоторых белковых веществ расшифровано, однако формулы таких веществ, как казеин, кератины, коллаген, применяются применяющихся в промышленности, неизвестны.
Казеин - сложный белок, образующийся из казеиногена (важнейшая составляющая молока, творога и сыра) при его свертывании под действием ферментов. Кроме атомов С, Н, О и N, в казеине содержится Р.
Кератины - белковые вещества, являющиеся главной составной частью тканей, выполняющих в животных организмах покровные и защитные функции (кожа, рог, волос, шерсть). Кератины характеризуются высоким содержанием серы.
Коллаген - белковое вещество, составная часть соединительной ткани; в частности, очень много коллагена содержится в костях животных.
Специальной обработкой костей, рогов и кожи животных в промышленности получают желатин - смесь белковых веществ животного происхождения.
Белки являются теми молекулярными инструментами, при помощи которых генетическая информация реализуется.
Именно информация, содержащаяся в линейной последовательности нуклеотидов ДНК, определяет линейную последовательность аминокислот в полипептидной цепи синтезируемого белка. Образовавшаяся линейная полипептидная цепь сама теперь оказывается наделенной функциональной информацией, в соответствии с которой она самопроизвольно преобразуется в определенную стабильную трехмерную структуру. Таким образом, лабильная полипептидная цепь складывается, скручивается в пространственную структуру белковой молекулы, причем не хаотично, а в строгом соответствии с информацией, содержащейся в аминокислотной последовательности.
9. Химические связи в белковой молекуле
В целом белковая молекула характеризуется наличием прочных ковалентных и относительно слабых не ковалентных связей. Такое сочетание связей обеспечивает белкам определённую прочность и динамичность в процессе функционирования.

Рис. 3. Химические связи в белковой молекуле.
На рисунке показаны типы связей между радикалами аминокислотных остатков в белковой молекуле.
а) электростатическое взаимодействие
б) водородные связи
в) взаимодействие неполярных боковых цепей, вызванное выталкиванием гидрофобных радикалов в «сухую» зону молекулами растворителя.
г) дисульфидные связи (двойная изогнутая линия означает хребет полипептидной связи)
Ковалентные связи в молекуле белка могут быть двух типов - дисульфидные и пептидные.
Пептидная или кислотноамидная (-СО-NH-) возникает при взаимодействии карбоксильной группы одной аминокислоты и a-аминогруппой другой.
С помощью рентгеноструктурного анализа было установлено, что связь между атомом карбонильной группы и атомом азота пептидной единицы имеет частично характер двойной связи.
Длина связи »0,132 нм, что является средней величиной между расстояниями, соответствующими двойной и одинарной связями между этими атомами. Связь - СО-NH - имеет транс - конфигурацию, и соседние атомы a-углерода находятся в транс-расположении. Транс-пептидная группировка является жесткой, и свободное вращение возможно только вокруг связей С-С и N-Ca. Вращение вокруг этих связей характеризуется различными углами.
Важную роль в стабилизации пространственной структуры белковой молекулы играют ковалентные дисульфидные связи (S-S), которые образуются в результате окисления сульфгидрильных групп остатка цистеина.
В стабилизации конформации белковой молекулы существенную роль играют не ковалентные связи и взаимодействия. К ним гидрофобные взаимодействия, электростатические, ионные, а также водородные связи.
Гидрофобное взаимодействие возникает при сближении гидрофобных углеводородных и ароматических радикалов некоторых аминокислот. Процесс гидрофобного взаимодействия можно представить как перемещение неполярных групп полипептидной цепи из воды в гидрофобные области.
Водородные связи образуются между атомами водорода, ковалентно соединёнными с атомом, который содержит не поделённую электронную пару, и другим электроотрицательным атомом (N или О). В белках и полипептидах водородные связи могут быть внутри - и межцепочечными. Внутрицепочечные водородные связи стабилизируют a-спиральные, а межцепочечные - b-складчатые структуры.
Ионные (солевые) связи образуются диссоциированными свободными карбоксильными группами (СОО-) моноаминодикарбоновых аминокислот и протонированными свободными аминогруппами (NH3+) диаминомонокарбоновых аминокислот. Ионные связи могут быть внутри - и межцепочечными.
10. Уровни структурной организации молекулы белка
Функциональные свойства белков определяются последовательностью аминокислот и конфигурацией, т. е. их структурной организацией или пространственной структурой. С этой точки зрения выделяют четыре уровня: первичная, вторичная, третичная и четвертичная структуры.
10.1. Первичная структура
Понимают качественный и количественный состав аминокислот, а также их последовательность расположения в полипептидных цепях белковой молекулы. Основу первичной структуры составляют пептидные связи.
Получить полный текстАнализ данных по первичной структуре позволяет сделать следующие выводы:
1. Стабильность первичной структуры обеспечивается, в основном, главновалентными пептидными связями; Возможно участие и небольшого числа дисульфидных связей.
2. В полипептидной цепи могут быть обнаружены разнообразные комбинации аминокислот; в полипептидах относительно редки повторяющиеся последовательности.
3. Каждый индивидуальный гомогенный белок характеризуется уникальной первичной структурой; частота замены аминокислот приводит не только к структурным перестройкам, но и к изменениям физико-химических свойств и биологических функций.
4. В некоторых ферментах, близкими свойствами, встречаются идентичные пептидные структуры, в особенности в областях их активных центров.

Рис. 4. Первичная структура РНКазы. (выделены четыре дисульфидные связи).
http://pandia.ru/text/78/042/images/image035_7.jpg" width="324" height="344 src=">
Рис. 6. a-спиральная а) полипептидная цепь a-пептидной конфигурации; б) скелет спирали.
10.2.2. b‑складчатая структура
При таком пространственном расположении аминокислотной последовательности образуется система параллельно и антипараллельно размещенных фрагментов одной или нескольких полипептидных цепей. Полипептидные цепи в b-складках полностью вытянуты.

Рис.7. b‑складчатая структура а) вид сбоку; б) вид сверху.
Складки появляются из-за того, что плоскости двух соседних пептидных связей образуют некоторый угол. Система стабилизируется благодаря поперечным водородным связям между цепями, расположенными перпендикулярно по отношению к ориентации пептидных связей
Расстояние между цепями составляет 0,95 нм, а период идентичности вдоль цепи-0,70 нм для параллельных цепей, и 0,65 нм для антипараллельных.
10.2.3. Коллагеновая спираль
Она состоит из трех спиралевидных тропоколлагена, имеющих форму стержня диаметром 1,5 нм и длиной около 300 нм. Спиралевидные цепи закручиваются одна вокруг другой и образуют суперспираль. Расстояние между двумя аминокислотными остатками по оси спирали составляет 0,29 нм. Коллагеновая спираль стабилизируется водородными связями, возникающими между водородом пептидных NH-групп остатков аминокислоты одной цепи и кислородом СО - групп аминокислотных остатков другой. Такая структура придает коллагену упругость и прочность.
10.2.4. Надвторичные структуры и структурные домены
Методами рентгеноструктурного анализа в настоящее время доказано существование ещё двух уровней структурной организации белковой молекулы, оказавшихся промежуточными между вторичными и третичными структурами. Это так называемы надвторичные структуры и структурные домены. Первые представляют собой агрегаты полипептидных цепей, обладающих собственной вторичной структурой и образующихся в некоторых белках в результате их термодинамической или кинетической стабильности.
10.3. Третичная структура
Под третичной структурой подразумевают пространственную ориентацию полипептидной спирали или способ укладки полипептидной цепи в определенном объеме.
Первым белком, третичная структура которого была выяснена Дж. Кендрью на основании рентгеноструктурного анализа, явился миоглобин кашалота.
http://pandia.ru/text/78/042/images/image038_4.jpg" width="389" height="239">
Рис. 9. Типы нековалентных связей, стабилизирующих третичную структуру.
а) электростатическое взаимодействие; б) водородная связь; в) гидрофобные взаимодействия неполярных групп; г) диполь‑дипольное взаимодействие; д) дисульфидная (ковалентная) связь
Третичная структура белка, после завершения его синтеза в рибосомах, формируется автоматически и полностью предопределяется первичной структурой.
Таким образом, линейная одномерная структура полипептидной цепи наделена информацией другого типа - конформационной, которая предопределяет собой образование белковой молекулы строго заданной формы с определенным пространственным расположением. В свою очередь, трехмерная структура белковой молекулы также содержит информацию, но уже совершенно другого типа, а именно функциональную, которую иначе называют интрамолекулярной информацией.
10.4. Четвертичная структура
Под этим понятием подразумевается характерный способ объединения и расположения в пространстве отдельных полипептидных цепей, составляющих одну функционально индивидуальную молекулу.
В формировании четвертичной структуры принимают участие водородные связи, электростатические, Ван-дер-ваальсовы и гидрофобные взаимодействия.
Для четвертичной структуры одних белков характерно глобулярное расположение субъединиц (гемоглобин), другие белки объединяются в спиральные четвертичные структуры по типу винтовой мозаики (вирус табачной мозаики)
Вывод
Таким образом, имеется четыре уровня структуры белковой молекулы. Все уровни структуры взаимосвязаны, и последовательность остатков аминокислот, или первичная структура, полностью определяет конформацию белковой молекулы. Проявление биологической активности зависит от высших уровней их структурной организации.
Литература
1. И др. Введение в химию полимеров: Учебное пособие для пед. ВУЗов/ и др. М., Высш. шк.,1988 г.
2. Дж. Оудиан. Основы химии полимеров. Пер. с англ. . Ред. чл.-корр. АН СССР В. В Кормака. Изд. «Мир», Москва, 1974 г.
3. А. Трилор. Введение в науку о полимерах. Пер. с англ. Изд. «Мир», Москва, 1973 г.
4. Перепеченко в физику полимеров.-М., «Химия», 1978 г.
5. Кормак строение и температурные характеристики полимеров. «Наука», 1970 г.
6. Тагер полимеров
7. Высокомолекулярные соединения: Учебник для ун‑тов.‑ 3‑е изд., -Высш. школа, 1981. -656с.
8. Кучеренко: учебник/Н. Е Кучеренко и др.- К: Выща шк., Изд-во при Киевском ун-те, 1988 г.
9. , Коровин химия: учебник под ред. .- М.: Медицина, 1983 г.
Возможно, будет полезно почитать:
- Йога для лица — описание комплекса упражнений для омоложения кожи ;
- Йога для омоложения организма ;
- Опасные упражнения в спортзале, которые стоит вычеркнуть из своей программы ;
- Skyrim: чит-коды оружия, навыков, брони и зaчарования Коды на скайрим эльфийские стрелы ;
- Классический подъем и ласточка ;
- Строение руки - иннервация ;
- Что такое, причины возникновения спастичности, недопущение и лечение Как убрать спастику после инсульта ;
- Способы как вызвать рвоту для похудения ;